さらし粉 に 塩酸
切迫 早産 上 の 子 預け 先 が ないさらし粉に塩酸HClを加えると塩素が発生するのはなぜ? | ねこ . さらし粉CaCl (ClO)・H2O は カルシウムイオンCa2+ と 塩化物イオンCl- と 次亜塩素酸イオンClO- がイオン結合した物質です。. すみだ 清掃 事務 所
玄米 水 につけ すぎ次亜塩素酸は弱酸なので、イオンの状態ClO - よりも次亜塩素酸HClOの状態の方が安定しています。. そのため、さらし粉に . 丸暗記からの脱出!【第2回 無機化学 さらし粉の利用】 - 化学 . さらし粉は第1回の②中和でも説明した通り、 水酸化カルシウム と塩化水素・次亜塩素酸の復塩です。 そして、この反応で重要なことは、次亜塩素酸が弱酸であるということです。 そのため、強酸の塩酸によって遊離させられることになります。 反応式は次の通りです。 CaCl (ClO)・H2O + HCl → CaCl2 + HClO + H2O・・①. さらし粉に塩酸を加えると、まず弱酸遊離反応がおこり、強酸強塩基の塩である 塩化カルシウム が生じ、次亜塩素酸が遊離します。 次に ②平衡の移動 についてです。 ①の反応によって次亜塩素酸が生じましたが、この次亜塩素酸と初めに加えた塩酸によって、さらに反応が進行します。 反応式は次の通りです。 HClO + HCl ⇆ Cl2 + H2O・・・②. さらし粉に塩酸をまぜるとなにになるの? - 化学反応式で表す . office を 更新 し てい ます しばらく お待ち ください
まねき 屋 デカールさらし粉に塩酸をまぜるとなにになるの? 化学反応式で表すとCaCl(ClO)・H2O+2HCl→CaCl2+2H2O+Cl2となり、塩素の発生に用いられます。. 無機化学「塩素の発生法」実験装置のポイントも押さえる . さらし粉や高度さらし粉で塩酸を発生させる際に 加熱は必要でありません。 酸化マンガン(Ⅳ)に濃塩酸を加える。 酸化マンガン(Ⅳ) に 濃塩酸 を加えると、 酸化還元反応が起こり塩素が発生 します。. さらし粉と塩酸から塩素が発生する理由は?(1) - 別府市学習塾 . さらし粉の化学式は ですが、これに を加えると何故 が発生する. のでしょうか? 反応は2段階に分かれます。 の は弱酸である次亜塩素酸 由来. の陰イオンなので、さらし粉 は弱酸の塩になります。 これに強酸である. を加えると、弱酸の遊離が起こります。 その反応式が下の①です。 ……①. 次に、①で生じた次亜塩素酸 と未反応の塩酸 で酸化還元反応が起こります。 は酸化数が-1、 の は酸化数が+1なので、間の酸化数0すなわち単体 が生じる. 反応が起こります。 少し話が長くなったので、今日はここまでにしておきます。 次亜塩素酸と塩酸の半反応式 ( を含む. 式)を考えてみてください。 文責:金藤. Follow me! 関連記事. 鶴見丘高校 6月期末ATが近づいてきました . 代表的な「気体の発生」について現役理系大学生ライターが . さらし粉と塩酸の反応について. では、さらし粉に塩酸を加えるとどうして塩素が発生するのでしょうか? HClを加えると、さらし粉に含まれているClO-と 弱酸の遊離反応 を起こし、HClOが遊離するんですね。 すると、 HClとHClOが酸化還元反応 を起こし、 HClO+HCl→H2O+Cl2↑. という反応が起き、高度さらし粉と希塩酸の反応も同じ原理で塩素が発生します。 化合物の気体について. image by iStockphoto. 単体の物質は当然数が限られていますが、化合物となると、様々元素の組み合わせとなり無数に存在します。 そのため、 化合物の気体は大量に存在 するので、全てを細かく紹介することはできません。. 代表的な「気体の発生」について現役理系大学生ライターが . 旦那 と 意見 が 合わ ない 離婚
トイレ の 換気扇 の 音 が うるさいさらし粉と塩酸の反応について. 化合物の気体について. 無機化合物の気体. 非金属水素化合物の気体について. フッ化水素の発生について. HClの発生方法. NH3の発生について. 非金属酸化物の発生について. 気体の発生は1種類ずつ整理していくしかない! ライター/どみにおん. 高校時代から気体の発生の実験も経験してきた化学に詳しい現役大学生。 気体って何? image by iStockphoto. みなさん、気体と聞くと簡単にイメージすることができると思いますが、言葉で説明するのは難しくないですか? しかし、実は簡単に説明できるんです! 気体とは 物質の状態のひとつ であり、 分子または原子が自由に動きまわれる状態 のことを言うんですね!. PDF 塩素の発生と性質 (20分). 化学実験. 塩素の発生と性質. (20 分) ( 目的) さらし粉から塩素を発生させその性質を調べてみる。 [ 準備] 試験管(2), ピンセット, ゴム栓(2), ろ紙と薬さじ[ 教卓上] 高度さらし粉,6 mol/L 塩酸, ヨウ化カリウムデンプン紙, 赤インク紙,青色リトマス試験紙, 純水、 銅粉[ 教卓上に], チオ硫酸ナトリウム水溶液[ ドラフト内] 塩素は有毒なので, 換気に注意し, 直接臭いを嗅がない。 1 試験管2 本に塩酸を3 mL[ 高さ1.5cm] ずつ取り, それぞれに高度さらし粉を4粒ずつピンセットで入れ, 軽くゴム栓をする。 しばらくすると試験管の半分程度の塩素が溜まる。. 塩素の製法 その2 - YouTube. さらし粉に希塩酸を加えると塩素が発生します。 高度さらし粉に希塩酸を加えても塩素が発生します。 さらし粉の化学式はちょっと複雑です。 書けますか? さらに高度さらし粉とさらし粉はどう違うのでしょう? #高校化学授業 #無機化学授業 #塩素#塩素の製法 #さらし粉 #高度さらし粉 #遠隔授業 #コロナに負けるな #小笠原理. 高度さらし粉と塩酸の反応を止めるのにチオ硫酸ナトリウムが . 高度さらし粉と塩酸の反応を止めるのにチオ硫酸ナトリウムが使われるのはなぜ? チオ硫酸ナトリウム Na2S2O3 は塩酸(強酸)とも塩素(酸化剤)とも反応する物質. 実験書などを見ると、高度さらし粉と塩酸の反応を止めるのに チオ硫酸ナトリウムNa2S2O3 が使用されます。 photo by wikipedia.org. チオ硫酸ナトリウムは チオ硫酸イオンS2O3 2- と ナトリウムイオンNa+ がイオン結合してできた塩です。 チオ硫酸イオンは チオ硫酸(弱酸)由来のイオン です。 チオ硫酸ナトリウムと塩酸の反応. チオ硫酸ナトリウムは塩酸とは次のような反応をします。 Na2S2O3 + 2HCl −→ 2NaCl + S + SO2 + H2O. さらし粉・次亜塩素酸ナトリウムの半反応式の作り方 | 化学の . 【プロ講師解説】このページでは『さらし粉・次亜塩素酸ナトリウムの半反応式の作り方』について解説しています。 半反応式の作り方. 半反応式は次の5STEPで作成する。 STEP1. 酸化剤(還元剤)が「何から何になるのか」を書く。 STEP2. 両辺について、OとH以外の原子の数を合わせる。 STEP3. 両辺について、O原子の数をH 2 Oを用いて合わせる。 STEP4. 両辺について、H原子の数をH + を用いて合わせる。 STEP5. 両辺について、電荷をe ー を用いて合わせる。 参考: 半反応式・酸化還元反応式(作り方・覚え方・問題演習など) さらし粉・次亜塩素酸ナトリウムの半反応式の作り方について、上の5STEPを用いて解説する。 STEP. さらし粉と高度さらし粉の違いとは? | ねこでもわかる化学. さらし粉は次亜塩素酸カルシウムCa (ClO) 2 と塩化カルシウムCaCl 2 の複塩からできています。 CaCl2は吸湿性があり、空気中の水分を吸収してCa (ClO)2を分解してHClOを遊離させてしまいます。 そのため、CaCl2を抽出して長期間保存に耐えられるようにしたものを高度さらし粉と呼びます。 さらし粉の組成式はCaCl (ClO)・H 2 O。 これを2倍にするとCaCl 2 ・Ca (ClO) 2 ・2H 2 Oとなるよ。 つまりさらし粉は塩化カルシウムと次亜塩素酸カルシウムの複塩だね。 CATEGORY :. PDF さらし粉に硫酸を加えると塩素が発生するのか - 奈良県立教育 . さらし粉に硫酸を加えると塩素が発生するのか. 前田祐作( 奈良県立畝傍高等学校) あらまし. さらし粉に硫酸を加えると、 塩素の発生が確かめられた。 キー ワード. 高度さらし粉、 硫酸、 不均化反応、 均等化反応、弱酸の遊離. 1はじめにびんに全体を移したうえで、ガラス板でふたをし無機化学分野の塩素発生の実験室的製法には、て気体を貯めたところ、うっすら黄緑色がかって2 種類の方法が紹介されている。 例えば、数研出版いたので塩素が発生していることが確認された。 の教科書「 化学」 に紹介されているのは、さらしつまり、高度さらし粉に希硫酸を加えても塩素粉に塩酸を加えて加熱しない方法と、も う一つは、が発生するということになる。. 【高校化学】さらし粉とは?化学式や主要な化学反応式(塩素 . このプロパティを特定の方法で使用すると、非常に理解しやすくなります。 また、カルキの「殺菌作用」と「漂白作用」について解説します。 さらし粉の主な化学反応についても解説しています。 ・塩素の発生 ・アニリンとの反応 入試に必要. 丸暗記からの脱出!【第1回 無機化学 さらし粉の生成】 - 化学 . さらし粉の製法は、『石灰水に塩素を加える』で反応式は次の通りです。 Ca (OH)2 + Cl2 → CaCl (ClO)・H2O. 覚えにくい・・・ 実はこの反応式は、多段階で反応しているので難しく感じているのです。 では、この反応式の分解して考えてみましょう。 まず結論ですが、反応は. 『①溶解→②中和』 の順に進みます! では、 ①溶解 から見ていきましょう。 塩素は中学校の理科でも水に溶けやすい気体として習います。 高校化学の視点から見ると、無極性分子なのになぜ? となりますよね。 この水によく溶ける性質は、化学反応によるものです。 反応式は次の通りです。 Cl2 + H2O ⇆ HCl + HClO・・・①. ※ 化学平衡 の反応であることも押さえておきましょう!. なぜ高度さらし粉と希塩酸の反応が - Clearnote. さらし粉と塩酸の反応は酸化還元反応です。塩酸が酸化力の強い次亜塩素酸によって酸化される反応が起きます。 具体的には ClO- + 2H+ + 2e-→Cl- + H2O (酸化剤) 2HCl→Cl2 + 2H+ + 2e- (還元剤) この2式を足し合わせて ClO- +2HCl→. 第45章 実験-塩素とヨウ素 - Osaka Kyoiku. 1-2 口径24mmの試験管に高度さらし粉(次亜塩素酸カルシウム)を小さじ1杯入れ,希塩酸を5mL加え,すぐにラップで試験管の口を覆う。 1-3 乾いた駒込ピペットをラップの中央に小さい穴をあけて差し込み,発生した塩素を吸い取る。 塩素は試験管3本分を捕集し,ゴム栓をしておく。 1-4 捕集が終わったら,チオ硫酸ナトリウム水溶液を口径24mmの試験管に加え,塩素の発生を止める。 1-5 塩素の入っている1本目の試験管に,湿らせたpH試験紙とヨウ化カリウムデンプン紙を近づけ,それぞれ素早く色の変化をみた後,試験管の中に入れ,ゴム栓をする。 さらに,うすい赤インクで湿らせたろ紙も試験管の中に入れ,ゴム栓をする。 実験終了後,塩素はドラフトに捨てること。. さらし粉(さらしこ)とは? 意味や使い方 - コトバンク. bleaching powder. 消石灰 ( 水酸化カルシウム )に 塩素 を吸収させて製造される 漂白剤 で、1799年イギリスのC・テナントにより発明された。 カルキ 、クロロカルキ、クロロ 石灰 ともいう。 名称は、「薄色にする」を意味するblaecanと、「 粉末 」を意味するpoudreに由来する。 Ca Cl 2 ・Ca ( ClO) 2 を 主成分 とするが、多量の消石灰が混在するため 有効塩素量 は30~38%で、不溶解物が多く、貯蔵中分解しやすいので、現在日本やアメリカでは工業用には生産されていない。. 2Cのページ. 目的:さらし粉に酸を加えたとき発生する塩素を有効塩素という。 0.1mol/L チオ硫酸ナトリウム標準液を用いて、有効塩素の定量をする。 実験のポイント. 「さらし粉水溶液のヨウ素還元滴定において、 遊離塩素の発生にちゅういする」 Key words: さらし粉水溶液 遊離塩素. デンプン添加前 終点. Q&A (過去のレポートより) Q1:ヨウ素滴定が良くわかりません。 A1:実験テキストより、チャート式などの参考書を読んでみてください。 さっきのページへもどる. 化学の質問です。高度さらし粉と塩酸が反応して塩素を発生 . さらし粉と塩酸の反応 さらし粉と塩酸を反応させて塩素を生成する反応 CaCl(ClO)・H2O+2HCl→ CaCl2+2H2O+Cl2↑ この場合の塩酸は希塩酸を使いますか?それとも濃塩酸でしょうか。 教材によって、希塩酸だったり濃塩酸だったりしますの. さらし粉に塩酸を加えるとあのような反応が起こる理由が . さらし粉は水酸化カルシウムも入ってるから混合物 塩酸と反応するのはCaCl (ClO)・H2OまたはCa (ClO)2で Ca (ClO)2 + 4HCl → CaCl2 + 2H2O + 2Cl2↑または CaCl (ClO)・H2O+2HCl→CaCl2+Cl2+2H2O 私が習ったのはCaCl (ClO)・H2O+2HCl→CaCl2+Cl2+2H2Oでしたが。 これを理解するにはまずこれを理解してください。 ☆Cl2+H2O⇔HClO+HCl これは ①Cl2⇔Cl^- + Cl^+ (水中で結合切れる) ②Cl^+ +H2O⇔HClO+ H^+ (Cl+は不安定だからH2OからOH-引っこ抜いて結合。. 塩素で花を脱色しよう | ねこでもわかる化学. 分子. ターセン の 光 年 期
美容 師 スタイリスト と は 
錦織 圭 の 追っかけCaCl (ClO)・H2O+2HCl→CaCl2+2H2O+Cl2↑. 上記のような反応が起るが、単純にさらし粉に塩酸を加えると塩素が発生することを知っておくと良い。 塩素は有毒なので注意。. アニリン | ねこでもわかる化学. 虎屋 ういろ 人気
顔 の 良性 腫瘍さらし粉水溶液との反応. アニリンブラック構造式. 無水酢酸とアミド形成. 製法. ベンゼン環にアミノ基が結合した化合物であり、最も単運な芳香族アミンである。 構造式. 性質. 有毒で無色の液体。 特異的な匂いがする。 酸化すると褐色に変化する。 弱塩基性 を示す。 水には溶けにくいが、塩基であるため塩酸に溶けて アニリン塩酸塩 を生成する。 さらし粉水溶液を加えると 赤紫色に呈色 するため、さらし粉はアニリンの検出方法として用いられる。 硫酸酸性K 2 Cr 2 O 7 水溶液で アニリンブラック(黒色物質) を生成する。 無水酢酸と反応して アミド ( アミド結合-NH-CO -を持つ化合物)を形成する。 アニリン塩酸塩. 高校化学ハロゲン(フッ素、塩素、臭素、ヨウ素)の性質と化学反応式まとめ - Irohabook. 塩素は17族ハロゲンの一つで、黄緑色・刺激臭の有毒な気体。工業的には食塩水の電気分解で集めるが、実験ではさらし粉に塩酸を加えるか、酸化マンガンに濃塩酸を加えるかで集める。塩素はプールの殺菌によく使われる。. 次亜塩素酸カルシウム - Wikipedia. アニリンにさらし粉や次亜塩素酸ナトリウムを加えると赤紫色に呈色する。また、硫酸酸性のK 2 Cr 2 O 4 水溶液で酸化するとアニリンブラックを生じる。 180℃の加熱により分解し、酸素を放出し酸化剤となる 。単独では燃焼しない 。. 高校化学 ハロゲン - Wikibooks. さらし粉に塩酸を加える。 . 塩酸には揮発性があり、常温で一部が気体となる。そのため、アンモニアのついたガラス棒を近づけると、塩酸の気体とアンモニアとが触れて反応し、塩化アンモニウム NH 4 Cl が生じる。この反応は、塩化水素やアンモニアの . 第85章 実験-アニリンとアセトアニリド - Osaka Kyoiku. アニリンがさらし粉CaCl(ClO)・H 2 Oによって酸化されるからです。 アニリンに濃塩酸を加えるとアニリンは溶けて均一な溶液になります。アニリン塩酸塩C 6 H 5-NH 3 + Cl - なったからです。これに水酸化ナトリウム水溶液を加えると再びアニリンが遊離し . 【質問】化学 (高校):高度さらし粉に塩酸を加えたとき、2Cl2+CaO+H2O とならないのはなぜですか?. 高度さらし粉に塩酸を加えたとき、 Ca(ClO) 2 +2HCl → 2Cl 2 +CaO+H 2 O とならないのはなぜですか? 〔回答〕 次亜塩素酸イオン(ClO - )が、ClO - +2H + +2e - → Cl - +H 2 O という動きをすることで、結果的に Ca 2+ が Cl - とくっつくことになるため . よく見える気体の反応 - J-stage. ① 塩素はさらし粉に塩酸を加えるなどの簡易的な方法で 発生させたものを下方置換で試験管に捕集し,シリコ ン栓をしておく。 ② 3 本の試験管に蒸留水,臭化カリウム水溶液,ヨウ化 カリウム水溶液をそれぞれ4 mLずつ入れる。. PDF Passlabo特別企画 無機化学反応式108 全パターン解説 (共通テスト×2次対策につながる深掘り解説付き). [70]さらし粉に希塩酸を加える反応 [71] ⽣⽯灰とコークスの混合物を2000℃に加熱してカーバイドを得る反応 [72]カーバイドに⽔を加えたときの反応 [73]セッコウを加熱し焼きセッコウを得る反応 [74]焼きセッコウを300℃以上に加熱した反応. 高度さらし粉と希塩酸の化学反応式のイオン式からの作り方を教えてください - 高. - Yahoo!知恵袋. さわやか な すしお ばら 館
この レコード セット は 更新 できません 
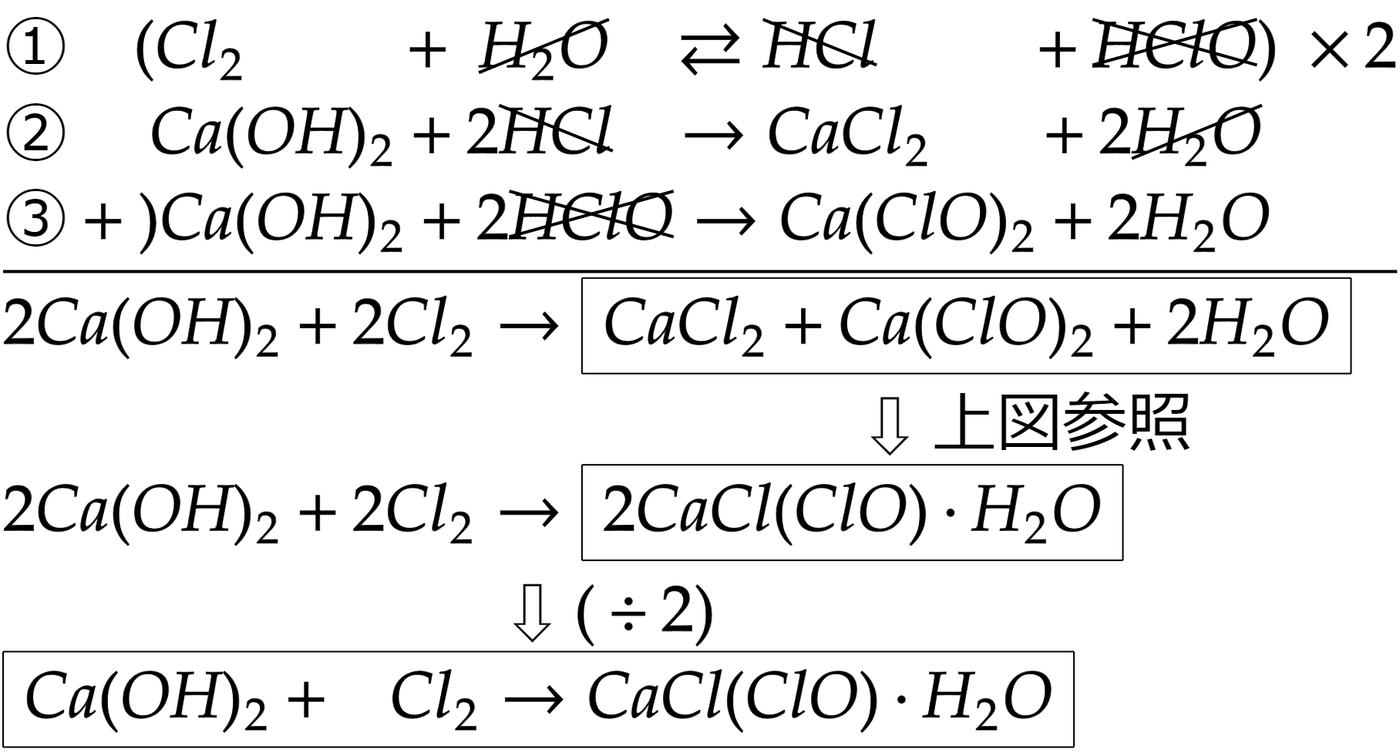
ウルトラ ジャパン vvip 入る に はさらし粉の化学式をどう書くかという問題はありますが、たとえばCaCl (ClO)・H2Oとかくなら、それに塩酸を加えた時の反応式は下記の . 酸化還元反応の化学反応式一覧(問題と答え)【化学反応式の王道】 | 大学受験の王道. ⑳亜鉛に希硫酸を注ぐ。 Zn + H 2 SO 4 → ZnSO 4 + H 2. 金属のイオン化傾向を完全に理解しよう(水との反応・酸との反応) ㉑亜鉛に希塩酸を注ぐ。 Zn + 2HCl → ZnCl 2 + H 2. ㉒酸化マンガン(Ⅳ)に濃塩酸を加えて熱する。 MnO 2 + 4HCl → MnCl 2 + Cl 2 + 2H 2 O ※塩素の製法. 化学反応式一覧(理論化学・無機化学)【大学受験】 | 大学受験の王道. ※塩素の検出方法に、青色リトマス紙を赤変後漂白というものがある。これは、塩素が水と反応することにより、塩酸と次亜塩素酸を生じ、塩酸が青色リトマス紙を赤変させ、次亜塩素酸によって漂白されるからである。 ⑤二酸化窒素を水に溶かす。. カルシウムの化合物 | ねこでもわかる化学. に わかるネコ より; なぜアルミニウムは過剰のアンモニア水を加えても錯イオンを形成しないの? に モカ より; なぜ酢酸カルシウムを乾留するとアセトンが得られるの? に best neet coaching in sikar より; D-乳酸とL乳酸、d-乳酸とl-乳酸の違いとは? に サカイ . 芳香族アミン:アニリンの性質とジアゾ化、ジアゾカップリング | Hatsudy:総合学習サイト. アニリン塩酸塩は水酸化ナトリウム水溶液を加え、中和することによってアニリンになります。 アニリンは弱塩基です。 アニリン塩酸塩に存在するCl - は強酸由来であるため、より強い塩基と結合したいと考えています。. アニリンの性質とアニリンの反応を徹底的にまとめてみた。. アニリン+さらし粉の赤紫色呈色反応. アニリンにさらし粉を入れると、さらし粉の酸化力によって、赤紫色になります。 さらし粉が酸化力を持つのは、次亜塩素酸イオンClO - の部分です。 入試に出るさらし粉の反応まとめ!化学式を2倍する方法とは?. 【化学 実験】塩素の発生・性質 - YouTube. 化学 第3部 無機物質 第1章 非金属元素と周期表 第3節 ハロゲンさらし粉と濃塩酸の反応による塩素の発生と、次亜塩素酸の漂白作用、塩素と銅の . 高度さらし粉と塩酸の反応式を教えてください - (*_*) - Yahoo!知恵袋. 化学の質問です。 高度さらし粉と塩酸が反応して塩素を発生する化学反応式の作り方が分かりません。 イオン反応式が Cl- + OCl- +2H+ → H2O +Cl2 となるところまでは理解できたのですが、 そこからどうしたら Ca(OCl)2・2H2O + 4HCl → CaCl2 + 4H2O + 2Cl2 という化学式になるのでしょう。. 高度さらし粉と塩酸の反応 - YouTube. About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy & Safety How YouTube works Test new features NFL Sunday Ticket Press Copyright . 塩基性にした過酸化水素水と塩素の化学発光. 図.1 塩基性にした過酸化水素水H2O2と塩素Cl2の化学発光. (2) 理論. さらし粉CaCl (ClO)・H2Oに塩酸HClを加えると、次のような化学反応が起こって、塩素Cl2が発生します。. CaCl (ClO)・H2O + 2HCl → CaCl2 + 2H2O + Cl2 ・・・(I) 塩素Cl2は強い毒性を持つ気体ですが、その . 化学図表ウェブ - Hamajima. ヨウ素の昇華. ヨウ素は分子結晶で,融点付近で蒸発しやすいため,融解しないで昇華する。. ヨウ素の結晶をビーカーに入れ,その上部に冷水を入れたフラスコをセットする。. ビーカーを下から熱すると,昇華して気体になったヨウ素が,冷えたフラスコ . よろこび の 街 100 万 ドル 中野 店
中国 発祥 の もの気体の製法(反応式・原理・注意事項など) | 化学のグルメ. はじめに 【プロ講師解説】このページでは『気体の製法(反応式・原理・注意事項など)』について解説しています。 中性気体の製法 代表的な中性気体の製法を紹介する。 一酸化炭素CO 【脱水】ギ酸HCOOHに濃硫酸を加えて加熱する [ mat . 
二クロム酸カリウムが酸性下で . 高度さらし粉とホノレマリン混合液の 消毒効果に関する一考察. 高度さらし粉(200倍)と ホルマリン(2%)と を混合した場合の消毒効果が,単 独使用よ りもとくに勝ることのない理由についての考察の一つとして,混 合後の有効塩素量およびpH の消長の観点から検討した。. (1)現 在,市 販されている高度さらし粉剤としての . 有機化合物(芳香族)の分離法〜仕組みや実験手順などを解説〜. アニリンを含む有機溶媒に塩酸を加えると、中和反応が起きてアニリンがアニリン塩酸塩となり、水層へ移動する。 次に、強塩基である水酸化ナトリウム水溶液を加えると、弱塩基のアニリンが遊離して( 弱塩基遊離反応 )再び有機溶媒層へと移動する。. カルキとは何か?人体への影響は?除去方法や注意点まで詳しく解説! | 家事 | オリーブオイルをひとまわし. 水道水には「カルキ」と呼ばれる成分が含まれている。聞いたことはあるが、詳しく知らないという方も多いのではないだろうか?本稿ではカルキの役割や身体への影響といった基礎知識、水垢との違いや除去の必要性、水まわりにできてしまったカルキ(水垢)汚れの落とし方などを詳しく . さらし粉と塩酸の反応について質問です。 - Yahoo!知恵袋. 化学の質問です。 高度さらし粉と塩酸が反応して塩素を発生する化学反応式の作り方が分かりません。 イオン反応式が Cl- + OCl- +2H+ → H2O +Cl2 となるところまでは理解できたのですが、 そこからどうしたら Ca(OCl)2・2H2O + 4HCl → CaCl2 + 4H2O + 2Cl2 という化学式になるのでしょう。. 【高校無機化学】ハロゲン(17族)(フッ素、塩素、臭素、ヨウ素)の製法と性質まとめ | 受験の月. ハロゲン(17族)(フッ素、塩素、臭素、ヨウ素). 2019.06.13. 検索用コード. ハロゲン単体の性質 $17属元素, 価電子数7 であるから, 1価の陰イオンになりやすい.$ 単体 常温 色酸化力 (反応性) 毒性} 水との反応 水素との反応}淡黄色} 有毒} 激しく反応}冷暗所